- 首页 > 正文
不惧耐药!详解HIV耐药性与指南推荐的一线ART方案丨专家述评
感染医线 发表时间:2023/9/11 17:25:06
截至2022年底,全世界约有3900万HIV感染者,其中2980万正在接受抗反转录病毒治疗(ART)[1]。过去的几十年中,随着ART的普及,HIV耐药率也随之增长,伴随耐药谱的变化,HIV耐药可能会损害ART药物的有效性[2],部分抵消ART在降低HIV相关疾病发病率和死亡率、及HIV传播方面的获益[3]。
因此,世界卫生组织(WHO)提出,为降低HIV耐药的出现和传播,应提高优化的ART方案的可及性,支持持续的治疗与照护,提高病毒载量监测的频率,以及时了解ART的有效性及转换治疗方案的时机[1]。
各大国际指南中推荐的一线ART,尤其是基于整合酶抑制剂(INSTI)的ART已经具有非常高的耐药屏障,在临床实践中,HIV感染者启动或转换ART时,是否无需对HIV的耐药性多做考量?本期,我们特邀成都市公共卫生临床医疗中心的蔡琳教授与大家探讨一线ART方案与HIV耐药性之间的相互影响。

01
指南推荐的一线ART方案具有高耐药屏障
根据WHO的《2021年艾滋病毒耐药性报告》[4],2014-2020年间,20个向WHO报告调查结果的国家中,有16个报告最常用的ART方案为以非核苷类反转录酶抑制剂(NNRTI)为基础的方案,主要包括奈韦拉平(NVP)和依非韦伦(EFV),在四类ART药物中,NNRTI类耐药率最高,汇总分析中EFV或NVP的总耐药率为12.9%,在有ART药物使用史的亚组中更是高达23.6%,是无使用史亚组(7.2%)的3倍多。相比之下,INSTI的总耐药率仅为0.6%。
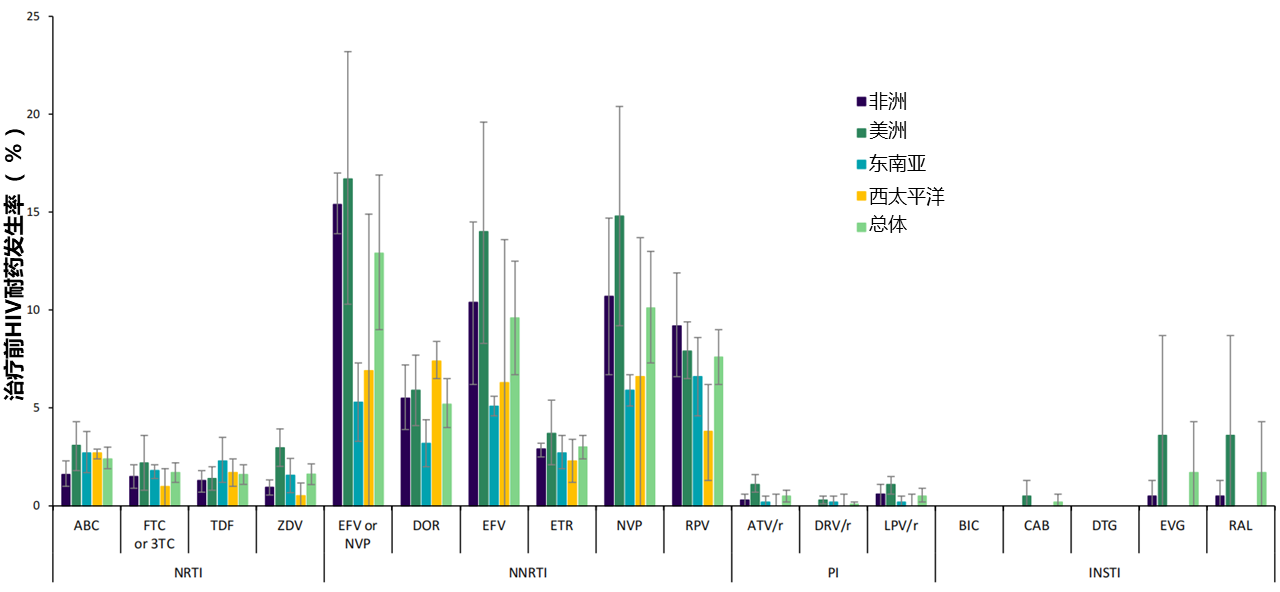
四类ART药物在不同地区和总体的治疗前HIV耐药率[4]
在中国,基于2021年报告的抗病毒治疗失败后耐药检测结果的分析显示,28510例治疗失败的HIV感染者中发生耐药的比例为51.2%。使用《国家免费艾滋病抗病毒药物治疗手册》中一线ART方案者发生耐药的比例为52.3%,其中对核苷类反转录酶抑制剂(NRTI)耐药的比例为27.4%,拉米夫定(3TC)耐药率为26.1%,富马酸替诺福韦二吡呋酯(TDF)为14.9%,齐多夫定(AZT)为4.6%,对两个NRTI耐药的为15.8%。NNRTI耐药的比例为48.8%[5]。
由此可见,由于NNRTI耐药率高,所以目前的国际各大指南均推荐一线ART方案采用耐药屏障较高的基于INSTI的方案。
如图:各大国际指南推荐的一线ART方案是基于INSTI的三联方案为主[6-8]。
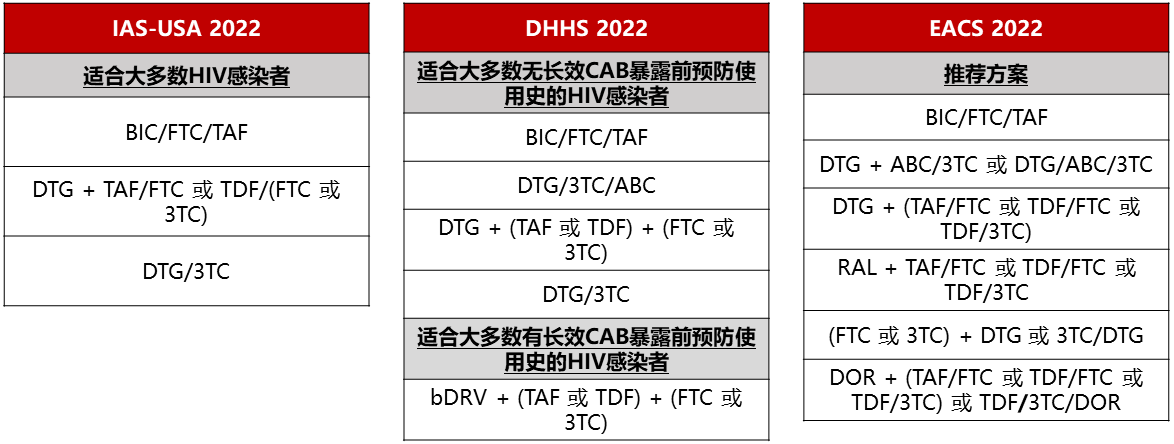
IAS-USA、DHHS和EACS指南推荐的一线ART方案[6-8]
多替拉韦/拉米夫定(DTG/3TC)仅可用于HIV RNA<500,000拷贝/mL且未合并HBV感染的HIV感染者,不可用于未获得基因型耐药检测结果前的快速启动[6-8],如有暴露前预防(PrEP)失败史,不建议将此方案作为ART启动方案[8]。
02
一线ART在治疗中产生的耐药
指南推荐的基于INSTI的ART方案,不同方案在临床试验和真实世界研究中产生耐药的HIV感染者比例以及对治疗产生的影响也有所差别。
5项探索比克替拉韦/恩曲他滨/丙酚替诺福韦(B/F/TAF)与其他三联ART方案的疗效非劣效性III期临床研究中,在最长随访到144周的时间内,B/F/TAF组均未出现耐药[9-13]。
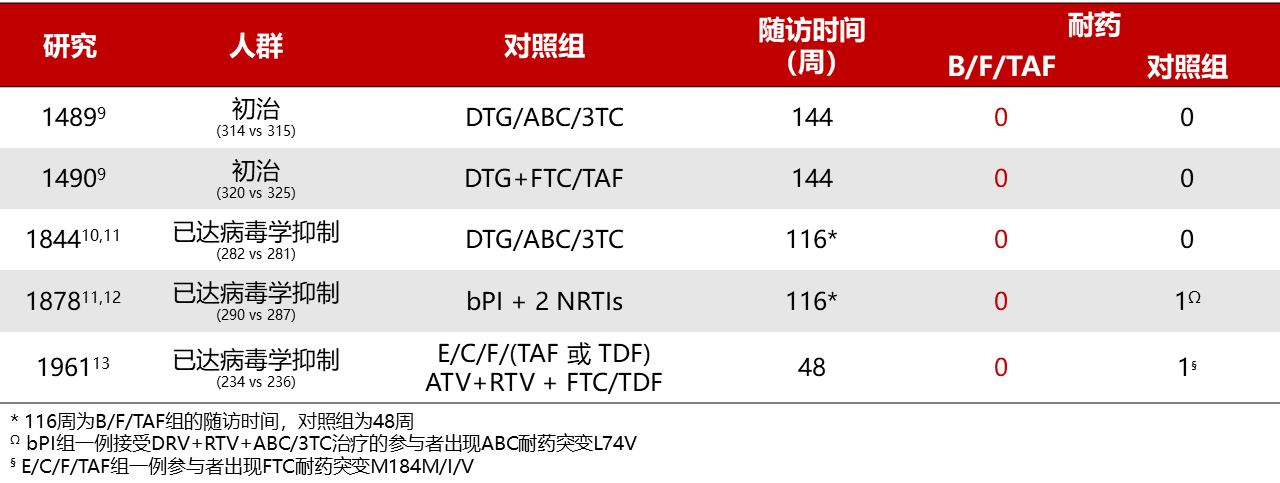
5项III期临床试验中,B/F/TAF组和对照组的耐药发生情况
不同于临床研究的参与者有着严格的入组条件,真实世界研究体现了更广泛的HIV感染群体的特性。一项综述研究在PubMed、EMBASE和Medline等7个医疗保健数据库中进行了B/F/TAF真实世界研究的检索和筛选,最终纳入了17项研究的8847例参与者,有4项研究评估了治疗中出现的耐药,仅有1项研究中的1例预存M184V/I突变的参与者(3%)在治疗中检测到INSTI耐药突变R263K[14]。提示B/F/TAF由于较高的耐药屏障,其在真实世界中也极少出现治疗中耐药。
在单臂试点研究ACTG5353中,初治的HIV感染者接受二联方案DTG+3TC治疗后,1例病毒学失败的参与者在第8-14周内发生M184V和R263R/K突变[15]。
在探索初治HIV感染者使用DTG+3TC相比DTG+TDF/FTC的非劣效性的GEMINI-1/2研究中,常规耐药检测在CVW(确认病毒学退出)参与者中进行,CVW定义为连续两次的HIV RNA检测值达到无病毒学应答或病毒学反弹(无病毒学应答定义为治疗12周时血浆HIV RNA下降<1 log10拷贝/mL且未达到<200拷贝/mL,或24周时及之后≥200拷贝/mL;病毒学反弹定义为已达血浆HIV RNA<200拷贝/mL后反弹至≥200拷贝/mL)[16]。在CVW参与者中,没有发现治疗后INSTI或NRTI突变。值得注意的是,CVW的标准使一部分可能发生耐药的参与者被排除在耐药检测之外。DTG+3TC组1例报告依从性差的非CVW参与者在132周时检测到M184V突变,144周时检测到R263R/K突变[17]。
一项基于意大利抗病毒响应队列分析(ARCA)数据库的回顾性研究纳入了626例已达病毒学抑制的HIV感染者,由基于蛋白酶抑制剂(PI)或NNRTI的三联方案转换为基于DTG的三联方案或DTG+3TC二联方案。转换后2年时的病毒学失败(连续两次HIV RNA≥50拷贝/mL或一次HIV RNA≥200拷贝/mL)发生率没有显著差异(7.6% vs. 4.5%,p=0.055),但二联方案且既存耐药突变与病毒学失败风险显著增加有关,尤其是M184V/I但无胸腺嘧啶类似物突变(TAM)者,6个月时,其风险为使用三联方案且没有耐药突变者的7.53倍(p=0.010),24个月时为9.18倍(p=0.003)[18]。
一项多中心回顾性研究[19]在2013-2022年间纳入了加拿大、欧洲和南非地区8个队列的750例初治HIV感染者,参与者接受基于DTG的ART后病毒学失败且有基因型耐药检测结果,其中79.6%为三联及以上方案,17.9%为二联方案,2.5%为单药方案。13.3%的参与者检测到INSTI耐药突变,2.8%有2个及以上的突变,最常见的为R263K,其余包括G140、N155、Q148和E138突变等。
相比三联及以上方案,单药方案(aOR 37.25)和DTG/3TC的二联方案(aOR 6.59)均与DTG耐药风险增加有关,既存潜在低/低水平(aOR 4.62)或中等/高水平(aOR 7.01)NRTI耐药也与DTG耐药风险增加有关,病毒载量表现出与DTG耐药风险增加有关的趋势,但统计学意义不显著。
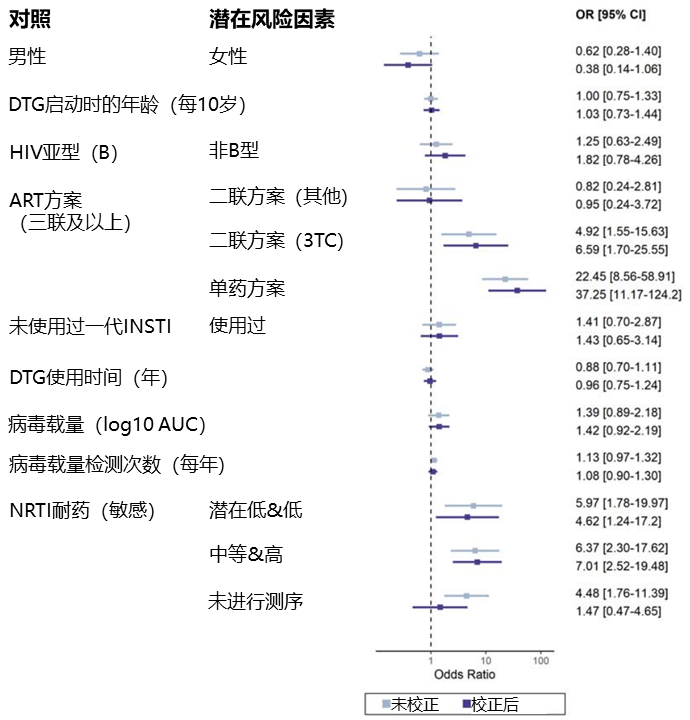
潜在风险因素相比对照因素,与DTG耐药风险的关联
巴西的一项研究[20]纳入了2017-2018年巴西公共卫生系统中一线接受DTG联合替诺福韦/拉米夫定(TL+D)治疗至少6个月后病毒学失败的113例HIV感染者,7例(6.19%)检测到主要的整合酶耐药相关突变,28例参与者(24.8%)检测到与TL+D无关的突变,可能与传播性耐药(TDR)有关。在这项研究中,一线TL+D方案治疗病毒学失败后,整合酶耐药相关突变水平相对较高。通常来说,TL+D三联疗法相比L+D二联疗法具有更高的耐药屏障,前文所述的GEMINI[17]和ACTG5353研究[15]均体现了这一点,基于DTG的二联疗法可能比TL+D有更高的耐药突变风险。虽然DTG特异性耐药突变,例如整合酶密码子263位点的突变可降低毒株适应性,在病毒学失败时一般病毒载量较低,但本真实世界研究显示,随用药时间积累,病毒适应性可呈恢复趋势,在病毒学失败时也有高病毒载量的出现。与DTG耐药有关的HIV基因组区域,例如3’PPT,可能在恢复HIV适应性方面发挥作用。
03
在预存耐药的HIV感染者中,一线ART的有效性
WHO《2021年艾滋病毒耐药性报告》显示,NRTI治疗前耐药率为5.4%,常见的NRTI耐药突变包括M184V/I和K65R等,它们会降低病毒复制,因此即使存在上述突变,TFV类药物作为ART方案的成分之一应用仍然具有病毒抑制的效力[21]。同为TFV的前体药物,TAF和TDF对发生K65R突变的毒株,抑制效率也不尽相同。一项体外研究[22]显示,TAF和TDF对HIV毒株的敏感性与包含K65R的突变高度相关,是野生型的2.7-3.0倍(K65R单一突变)和1.2-27.6倍(K65R+其他反转录酶突变)。在病毒学突破实验中,42株临床分离毒株中,TAF抑制了其中40株的病毒学突破,而TDF只抑制了32株,这表明,相比TDF,TAF具有更高的对K65R的耐药屏障。具体来说,相较于TDF暴露时病毒学突破需倍数变化(FC)>4,TAF暴露时,需FC>8。
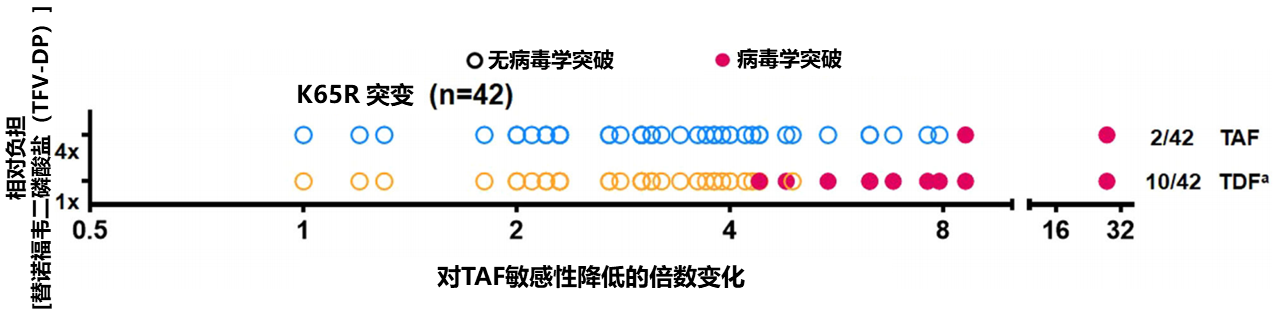
对应于体内浓度的TAF和TDF生理浓度条件下,携带K65R毒株的病毒学突破
一项合并分析研究[23]纳入了6项达病毒学抑制HIIV感染者转换为B/F/TAF的有效性和安全性的临床研究(4030/4580/1844/1878/4449/1474研究),共包含2034例参与者,1825例有历史和/或基线基因型检测结果,其中182例(10%)预存M184V/I突变。中位随访时间为72周。在最长180周的随访时间内,总参与者中HIV RNA<50拷贝/mL的比例为97-100%,预存M184V/I突变的亚组病毒抑制率同样高达98-100%,且没有出现B/F/TAF相关耐药。
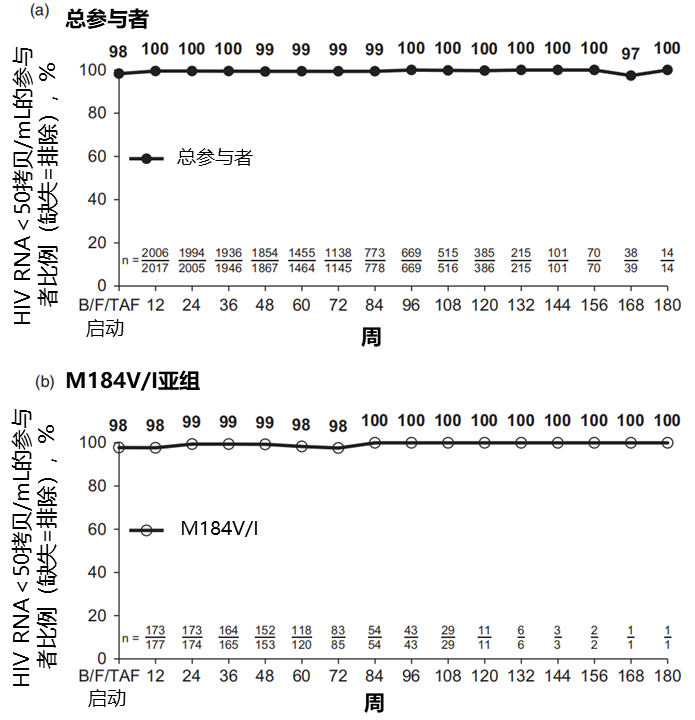
最长180周的随访时间内,总参与者(a)和M184V/I亚组(b)中HIV RNA<50拷贝/mL的比例
一项回顾性研究[24]纳入了72例已达病毒学抑制但有病毒学失败史且出现K65N/R的HIV感染者,其中42例(59.7%)同时存在M184V/I,9例(12.5%)存在≥1个胸腺嘧啶类似物突变。转换为B/F/TAF后,在长达98.6周的中位随访期内,94.4%仍在使用B/F/TAF,48周时,仅有2例参与者(2.8%)失去病毒学抑制(血浆HIV RNA>50拷贝/mL),M184V/I与病毒学反弹无关。
这些研究的结果表明,即使体外研究显示替诺福韦(TFV)对K65R突变的毒株会使药物敏感性下降,但临床研究和真实世界研究均证实,存在M184V/I和/或K65R的HIV感染者使用B/F/TAF仍能够维持高病毒学抑制率。
一项在2014-2020年间纳入了628例HIV感染者的回顾性研究[25]显示,预存M184V/I的病毒学抑制HIV感染者转换为DTG/3TC,相比DTG+TDG/FTC和DTG/ABC/3TC的三联方案,病毒学失败风险显著增加(aHR分别为137.50和33.88)。这再次印证了基于DTG的三联方案相比二联方案具有更高的耐药屏障。
04
专家点评
随着联合国艾滋病联合规划署(UNAIDS)提出的“95-95-95”目标,HIV感染者获得诊断并接受ART的数量持续上升,这预计会一定程度上增加HIV耐药率,相应的,如果已经启动ART的人群中HIV耐药率上升到较高水平,可能将影响第三个“95”目标(95%接受ART的HIV感染者达到病毒学抑制)的达成。
各国际指南推荐的一线ART药物,特别是基于INSTI的方案具有较高的耐药屏障,但从临床和真实世界的研究中观察到,同为一线ART方案,不同方案在治疗中耐药的发生率也有所差别,其产生的耐药对疗效的影响仍然存在;同时,在预存耐药的HIV感染者中,基于INSTI的三联方案相较二联方案有更高耐药屏障。因此在新一代ART的时代对耐药的检测和监测仍不可忽视。
另外,随着HIV暴露高风险群体预防意识的增强,PrEP(暴露前预防)的应用也在持续增长,高依从性的PrEP显著降低了HIV感染风险,值得关注的是,在有PrEP史的HIV感染者中,耐药的存在更为常见,这也是HIV耐药发展、传播和监测中亟需关注的一点。DHHS指南指出,对于有长效卡替拉韦(CAB-LA)PrEP使用史的HIV感染者,应在ART启动前进行INSTI基因型耐药检测[7]。
为了管理和控制HIV耐药的发展,WHO的《2017-2021年艾滋病毒耐药性全球行动计划》[26]提出了5个关键行动,包括预防和应对、监测和监督、研究和创新、实验室能力,以及治理和支持性机制,这对于实现2030年遏制HIV流行也十分关键。关键行动围绕的核心即扩大病毒载量和耐药性检测、建立耐药性监测的实验室能力、采用高耐药屏障和高药物宽容度的ART,并提升对HIV感染者的照护、药物供给和患者教育的支持。
以B/F/TAF为代表的基于INSTI的三联疗法成为当前各国际指南的一线推荐,既能够达到并维持高病毒学抑制率、预存耐药突变不会对疗效造成显著影响,即使在真实世界中也极少出现治疗中耐药,并具有良好的安全性和耐受性,其广泛应用有利于将HIV感染与传播的公共卫生影响降至尽可能低的程度。
*本材料的目的是通过介绍有关医学和科学信息和进展,提高医学专业人士的医学知识。因此,本材料仅供医学专业人士使用。本材料并非药品广告。读者不应参考或依赖本材料的任何内容,做出购买或使用任何药品的任何决定。
参考文献
[1] UNAIDS. Fact sheet - Latest global and regional statistics on the status of the AIDS epidemic. Accessed: July 2023. Available at:https://www.unaids.org/en/resources/documents/2023/UNAIDS_FactSheet.
[2] Bertagnolio S, Hermans L, Jordan M R, et al. Clinical impact of pretreatment human immunodeficiency virus drug resistance in people initiating nonnucleoside reverse transcriptase inhibitor–containing antiretroviral therapy: a systematic review and meta-analysis[J]. The Journal of Infectious Diseases, 2021, 224(3): 377-388.
[3] Phillips A N, Stover J, Cambiano V, et al. Impact of HIV drug resistance on HIV/AIDS-associated mortality, new infections, and antiretroviral therapy program costs in sub–Saharan Africa[J]. The Journal of infectious diseases, 2017, 215(9): 1362-1365.
[4] WHO. HIV drug resistance report 2021. Accessed: November 2021. Available at: https://www.who.int/publications/i/item/9789240038608.
[5] 赵燕, 甘秀敏, 赵德才, 等. 我国艾滋病抗病毒治疗进展及推进高质量发展的思考[J]. 中国艾滋病性病, 2023, 06: 619-622.
[6] Gandhi R T, Bedimo R, Hoy J F, et al. Antiretroviral drugs for treatment and prevention of HIV infection in adults: 2022 recommendations of the International Antiviral Society–USA Panel[J]. JAMA, 2023, 329(1): 63-84.
[7] DHHS. Guidelines for the Use of Antiretroviral Agents in Adults and Adolescents Living with HIV. Accessed: March 2023. Available at: https://clinicalinfo.hiv.gov/sites/default/files/guidelines/documents/adult-adolescent-arv/guidelines-adult-adolescent-arv.pdf.
[8] EACS. Guidelines for treatment of people living with HIV version 11.1. Accessed: October 2022. Available at: https://www.eacsociety.org/media/guidelines-11.1_final_09-10.pdf.
[9] Orkin C, DeJesus E, Sax P E, et al. Fixed-dose combination bictegravir, emtricitabine, and tenofovir alafenamide versus dolutegravir-containing regimens for initial treatment of HIV-1 infection: week 144 results from two randomised, double-blind, multicentre, phase 3, non-inferiority trials[J]. The Lancet HIV, 2020, 7(6): e389-e400.
[10] Molina J M, Ward D, Brar I, et al. Switching to fixed-dose bictegravir, emtricitabine, and tenofovir alafenamide from dolutegravir plus abacavir and lamivudine in virologically suppressed adults with HIV-1: 48 week results of a randomised, double-blind, multicentre, active-controlled, phase 3, non-inferiority trial[J]. The Lancet HIV, 2018, 5(7): e357-e365.
[11] Andreatta A, et al. CROI 2019. Seattle, WA. Poster 552.
[12] Daar E S, DeJesus E, Ruane P, et al. Efficacy and safety of switching to fixed-dose bictegravir, emtricitabine, and tenofovir alafenamide from boosted protease inhibitor-based regimens in virologically suppressed adults with HIV-1: 48 week results of a randomised, open-label, multicentre, phase 3, non-inferiority trial[J]. The lancet HIV, 2018, 5(7): e347-e356.
[13] Kityo C, et al. CROI 2018. Boston, MA. Poster 500.
[14] Peters E, Iwuji C. Efficacy, safety and tolerability of Biktarvy in HIV-1 infection: a scoping review[J]. Antiviral Therapy, 2023, 28(1): 13596535231159030.
[15] Taiwo B O, Zheng L, Stefanescu A, et al. ACTG A5353: a pilot study of dolutegravir plus lamivudine for initial treatment of human immunodeficiency virus-1 (HIV-1)–infected participants with HIV-1 RNA< 500000 copies/mL[J]. Clinical Infectious Diseases, 2018, 66(11): 1689-1697.
[16] Cahn P, et al. AIDS 2018. Amsterdam, NL. Oral TUAB0106LB.
[17] Cahn P, et al. HIV Drug Therapy 2020. Glasgow. P018.
[18] Borghetti A, et al. CROI 2023, Poster 574.
[19] Loosli T, Hossmann S, Ingle S M, et al. HIV-1 drug resistance in people on dolutegravir-based ART: Collaborative analysis of cohort studies[J]. medRxiv, 2023.
[20] Diaz R S, Hunter J R, Camargo M, et al. Dolutegravir-associated resistance mutations after first-line treatment failure in Brazil[J]. BMC Infectious Diseases, 2023, 23(1): 347.
[21] Brenner B G, Coutsinos D. The K65R mutation in HIV-1 reverse transcriptase: genetic barriers, resistance profile and clinical implications[J]. HIV therapy, 2009, 3(6): 583-594.
[22] Cox S, Margot N, Callebaut C. Antiviral activity of tenofovir alafenamide (TAF) against HIV‐1 clinical isolates harboring K65R[J]. Journal of Medical Virology, 2023, 95(4): e28723.
[23] Sax P E, Andreatta K, Molina J M, et al. High efficacy of switching to bictegravir/emtricitabine/tenofovir alafenamide in people with suppressed HIV and preexisting M184V/I[J]. AIDS, 2022, 36(11): 1511-1520.
[24] Tsai M S, Sun H Y, Chen C P, et al. Switching to coformulated bictegravir, emtricitabine, and tenofovir alafenamide maintained viral suppression in adults with historical virological failures and K65N/R mutation[J]. International Journal of Infectious Diseases, 2023, 126: 39-47.
[25] Borghetti A, Alkhatib M, Dusina A, et al. Virological outcomes with dolutegravir plus either lamivudine or two NRTIs as switch strategies: a multi-cohort study[J]. Journal of Antimicrobial Chemotherapy, 2022, 77(3): 740-746.
[26] WHO. Global action plan on HIV drug resistance 2017–2021. Accessed: July 2017. Available at: https://www.who.int/publications/i/item/978-92-4-151284-8.
来源:《感染医线》
声 明
凡署名原创的文章版权属《感染医线》所有,欢迎分享、转载(开白可后台留言)。本文仅供医疗卫生专业人士了解最新医药资讯参考使用,不代表本平台观点。该等信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议,如果该信息被用于资讯以外的目的,本站及作者不承担相关责任。
.png)
责任编辑:彭伟彬
相关搜索: HIV